Dra. Catalina Peralta Cortázar1
1Endocrinóloga pediatra UMAE 48 IMSS León, Capítulo León,
Bol Cient Cult Col Ped Gto 2023;1(4):46-53
Ilustraciones por Camila Urzúa Peralta
El estudio de lo que en la actualidad conocemos como diabetes mellitus tiene un amplio recorrido a lo largo de la historia y se remonta a más de 2000 años antes de nuestra era. Sin embargo, los métodos por los cuales se describía al inicio no eran tan científicos como en la actualidad, ya que quienes hablaban al respecto decían que era un padecimiento con una orina pegajosa y con sabor a miel, en realidad no estaban equivocados. Un médico, identificado como el padre de la medicina hindú, fue quien describió dos tipos de diabetes estableciéndolas a determinadas edades, pero una en personas con obesidad y otra en personas delgadas. Años después se informó que las personas con diabetes tenían exceso de azúcar en la sangre y su presencia en la orina. Poco a poco el estudio de la diabetes mellitus pasó a ser objetivo de una verdadera ciencia, como la medicina, logrando identificar al páncreas como el sitio principalmente afectado y describiendo el proceso y los mecanismos por los cuales se presenta esta enfermedad. En 1921, Frederick Banting y Charles Best describieron a la hormona insulina creada en el páncreas, que está disminuida o ausente en las personas con diabetes. Actualmente la diabetes mellitus se define como un grupo de enfermedades metabólicas que se caracterizan por hiperglucemia ocasionada por defectos en la insulina, ya sea en su secreción, en la acción o en ambas.
También la búsqueda de un tratamiento ha creado un largo camino en la investigación, ya que la historia nos relata como prescribían tratamientos que hoy no imaginaríamos prudentes de llevar a cabo. En 1922 se aplica la primera inyección de insulina en un chico de 14 años y un año después inicia la producción y venta de la insulina, la cual durante todos estos años se ha ido perfeccionado y generando diversas preparaciones capaces de permitir control de la enfermedad. Desde 1960 gracias a las jeringas desechables es posible administrar la insulina con seguridad. Dentro del tratamiento, en ocasiones se requiere de una aplicación intensiva de insulina para evitar complicaciones y tener control estricto de los niveles de glucosa, lo que conlleva al menos 3 inyecciones diarias y chequeos frecuentes.
Esperando sea de gran utilidad, en este artículo encontrarán una breve descripción de las tecnologías y dispositivos utilizados en el control y tratamiento de los pacientes con diabetes mellitus y que requieren de insulina para su control.
DISPOSITIVOS PARA APLICACIÓN DE INSULINA
Bomba de Insulina. Es un dispositivo electrónico diseñado para administrar la insulina de forma continua. Estas bombas son los dispositivos más avanzados de administración de insulina, suelen programarse de forma muy específica para cada paciente, con los niveles de insulina basal requeridos, que permiten una infusión continua de forma subcutánea (por debajo de la piel), y aplican otros niveles de insulina que pueden modificarse e incrementarse haciendo la función de los bolos programados antes de las comidas tratando de simular la producción normal de insulina del páncreas. En 1963 el Dr. Arnold Cádiz (Kadish) diseña la primera bomba de insulina que era del tamaño de una mochila, “se colocaba en la espalda”. El primer modelo se le nombró “gran bloque azul”, el problema era que no tenía los controles necesarios para asegurar la administración de modo seguro, incluso requería de un destornillador para ajustar la dosis y era grande y pesada.
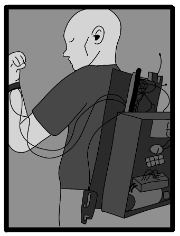
Figura 1. Primera bomba de insulina
En 1983 se crean las Bombas de insulina portátiles. Dispositivos fáciles de llevar y el primer modelo fue Minimed de Medtronic.

Figura 2. Bomba de insulina portátil.
Y te preguntarás ¿cómo funcionan estas llamadas “bombas” de insulina?, tienen un depósito que es similar a una jeringa normal de insulina, pero de un mayor tamaño, dentro del cual se pone insulina y permiten a quien la usa controlar la cantidad de insulina que se inyectará de forma continua subcutánea programándose en un estuche de plástico que contiene un chip de computadora y que además para su funcionamiento requiere de pilas. El depósito permite pasar la insulina al cuerpo mediante un tubo de plástico como manguera larga y delgada el cual se nombra “equipo de infusión” y que en la punta tiene una aguja blanda llamada cánula. Este equipo se cambia cada 3 días.
El beneficio es que permite tener insulina de forma continua las 24 horas del día, sólo realizando los ajustes necesarios y te ayuda a tener un tratamiento más exacto. Ayuda en el manejo de patrones irregulares de las comidas, permitiendo flexibilidad en los horarios, realizar ajustes necesarios para evitar hiperglucemia, menor riesgo a presentar hipoglucemias, así como en otros aspectos de la vida de los pacientes como durante el ejercicio, el tiempo de sueño etc.; ayudando a tener menos inyecciones. Sin embargo, es importante saber que no es automática, ya que quien la usa debe aprender el manejo de estos dispositivos y conocer los cuidados que permitan un mejor control de la glucosa.
Existen 2 tipos de bombas, las tradicionales o tipo bolsillo que son como la descrita previamente del dispositivo con el tubo tipo manguera, y las bombas tipo parche, también llamadas “pod” o cápsulas que se adhieren a la piel, requieren el llenado del depósito y también tienen una cánula, pero se manejan mediante un dispositivo inalámbrico que permite programar la administración de insulina. Se cambian cada 2 a 3 días y requiere de pilas.
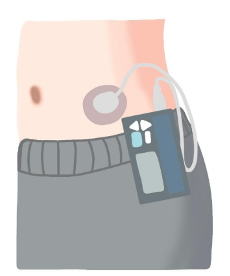
Figura 3. Bomba de insulina tipo bolsillo.

Figura 4. Bomba de insulina tipo parche.
Pluma de insulina. En 1985 surge la primera pluma de insulina, dispositivos que hacen más fácil y cómoda la administración de insulina al ser precargadas, desechables y existir con diferentes presentaciones y tipos de insulina. Existen insulinas con mayor concentración que ayudan a que el volumen que se inyecte sea menor siendo mejor la tolerancia en la inyección. Incluso, hay plumas que permiten administrar medias unidades, las cuales son útiles para aquellos pacientes que requieren pequeñas dosis de insulina como por ejemplo los niños.

Figura 5. Pluma de insulina
Actualmente existen plumas inteligentes que ayudan mediante un sensor además de a aplicar la insulina a llevar un registro de la hora de aplicación, la dosis y mediante una aplicación móvil por bluetooth monitorizar la temperatura de la insulina lo cual es de suma importancia para optimizar la conservación de la misma, ayuda a calcular bolos, nos muestra la cantidad de insulina activa, disponer de una alarma para que no se olvide la aplicación y permite descargar datos que puedan ayudar en la atención de los pacientes con diabetes al compartirla con sus médicos.


Figura 6. Pluma de insulina inteligente
Durante todo este desarrollo de los dispositivos, las jeringas y las plumas también han evolucionado las agujas reduciendo su longitud hasta 4 mm haciendo que el dolor en la punción sea el mínimo posible y asegurando la administración subcutánea.
A mediados del siglo XX aparecieron los sistemas de administración sin aguja, lo que disminuye el dolor en la administración y mejorando la tolerancia de las personas con miedo por las agujas. Este sistema consiste en aplicar alta presión sobre un depósito con insulina y la hace pasar por un orificio del diámetro de un cabello a gran velocidad.
Puerto de inyección. Otras alternativas son los “puertos” de insulina que son sistemas con una cánula o manguera pequeña de plástico que requiere una aguja muy pequeña para instalarse. Dentro de ella contiene una membrana que permite la administración de múltiples inyecciones de insulina a través del mismo puerto reduciendo el número de pinchazos, estos dispositivos se cambian cada 3 días haciendo menos dolorosa la aplicación con inyección de la insulina en las personas que viven con diabetes ayudando en el apego en una parte fundamental de su tratamiento.
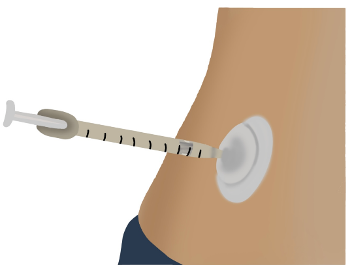
Figura 7. Puerto de inyección
DISPOSITIVOS DE MEDICIÓN DE GLUCOSA
Tiras reactivas. En 1965 se inventó la primera tira para la medición de la glucosa (Dextrostix). Estas requieren la aplicación de una gota de sangre y en tan sólo unos minutos después permiten saber el valor de glucosa. Al colocar la gota de sangre, el papel cambia de color y este puede ser comparado de acuerdo con los niveles de glucosa sugeridos en una guía de colores. Es algo fácil y rápido de realizar, sin embargo, nos proporciona resultados muy imprecisos.
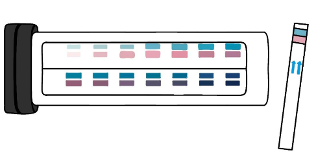
Figura 8. Tira dextrostic
Glucómetro. En el estudio de métodos para mantener vigilancia en los niveles de glucosa de los pacientes, en 1970 se crea por Anton Hubert Clemens el primer medidor portátil que facilita el monitoreo de los niveles de glucosa. Era prácticamente un lector de los resultados de las tiras reactivas y se le nombró glucómetro. En 1980 el primer glucómetro con pantalla digital, este registraba los niveles de glucosa.

Figura 9. Primer medidor portátil
En 1985 se crea el primer glucómetro con memoria que permitió almacenar datos del día, noche o cualquier momento en que el paciente lo realizara.
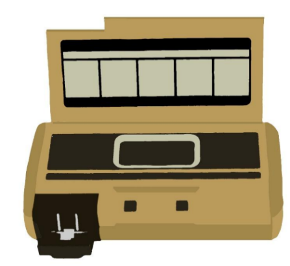
Figura 10. Primer glucómetro con memoria.
En la evolución, los dispositivos permiten mediante una flecha que le señala al usuario ver la tendencia o la dirección en la que se dirige su nivel de glucosa y con ello permitirle ajustar su tratamiento con insulina.
Dispositivos de monitorización continua. La investigación y la búsqueda por mejorar este monitoreo lleva en 1999 al primer dispositivo para monitoreo continuo de glucosa. Que son dispositivos que permiten medir la glucosa de forma continua.
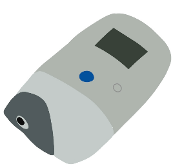
Figura 11. Primer dispositivo de monitoreo.
En el 2002 se crea el “Glucowath Biographer” un dispositivo como reloj que, mediante una técnica eléctrica aplicada en la piel, llamada iontoforesis inversa, estimula la secreción de líquido subcutáneo a partir del cual se medía la glucosa mediante un electrodo, sin embargo, aunque sonaba prometedor, no tuvo éxito por la irritación que creaba en dicha zona de la piel.
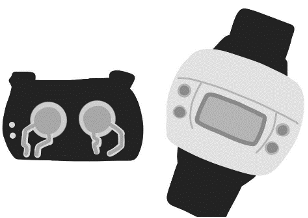
Figura 12. Glucowath
Para el 2004 las marcas Medtronic y Dexcom lanzan sus sensores de medición continua de glucosa, los cuales han evolucionado y se mantienen en la utilidad de las
personas que viven con diabetes contribuyendo en el manejo de su diagnóstico.
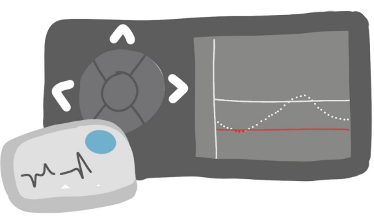
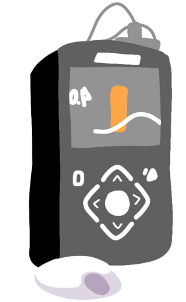
Figura 13. Sensores para medicion continua de glucosa.
En 2018 se aprueba el sistema de medición flash de glucosa Freestyle, sistema que en comparación con los otros no requiere calibración, pero si permite hacer mediciones continuas y ayudar en la toma de decisiones. Sin embargo, no guardaba datos, es por ello por lo que en su evolución progresa a lo que tenemos en la actualidad de 2da y tercera generación “Freestyle libre 2 y 3” que ya permiten ver al usuario sus niveles de glucosa sin escanear el sensor, además de contener alarmas de altas y bajas.
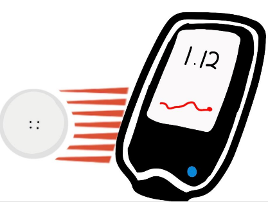
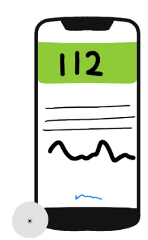

Figura 14. Medidores flash de glucosa 1, 2 y 3.
También en el 2018 llega el primer monitoreo continuo de glucosa implantable. Senseonics lanzaría “EVERSENSE” con duración de 180 días. Este dispositivo requiere su inserción en consultorio por un profesional de la salud, ya que es conectado a un transmisor removible.
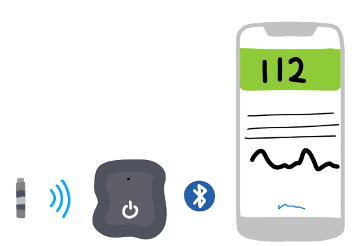
Figura 15. Monitor implantable.
En el 2000 surge y evoluciona el cuidado de la diabetes y partiendo de las creaciones que mejoran la administración, pero también el cuidado y monitoreo en los pacientes con diabetes surgen los sistemas integrados, que son realmente microinfusoras con sistema de monitoreo continuo de glucosa. Los beneficios son que además de enviar microinfusiones de insulina, calcular la dosis necesaria para las comidas y calcular dosis de corrección, cuenta con un sensor que mide la glucosa del líquido intersticial y que está acoplado a un transmisor que envía la información a la bomba, lo cual ayuda a realizar suspensión en la infusión de insulina para evitar hipoglucemias.


Figura 16. Sistemas integrados.
Es así como terminamos esta breve reseña, no sin antes mencionar que en las últimas décadas se han visto avances muy importantes en las tecnologías para el tratamiento de la diabetes, tecnologías que, si bien no todas están disponibles en todo el mundo, el conocerlas nos hace cada vez menos lejana la posibilidad de que en un futuro cercano todos los pacientes que viven con diabetes tengan acceso a lo que para ellos sea su mejor opción en su control y tratamiento.
BIBLIOGRAFIA.
1.- Villalba LM. Diabetes mellitus: los orígenes de un no tan dulce término. MÉD.UIS.2022;35(3):75-81.
2.- García de Alba-García JE, Salcedo-Rocha AL, Milke-Najar ME, Alonso-Reynoso C, García de Alba-Verduzco JE. Consideraciones sobre el saber médico heredado en México del siglo XIX: el caso de la diabetes mellitus [Considerations concerning medical knowledge inherited in Mexico from 19th century: the diabetes mellitus case]. Rev Med Inst Mex Seguro Soc. 2017 Jul-Aug;55(4):520-531. Spanish.
3.- Apablaza P, Soto N, Codner E. De la bomba de insulina y el monitoreo continuo de glucosa al páncreas artificial [From insulin pump and continuous glucose monitoring to the artificial pancreas]. Rev Med Chil. 2017 May;145(5):630-640.
4.- Beck RW, Bergenstal RM, Laffel LM, Pickup JC. Advances in technology for management of type 1 diabetes. Lancet. 2019 Oct 5;394(10205):1265-1273.
5.-Cappon G, Vettoretti M, Sparacino G, Facchinetti A. Continuous Glucose Monitoring Sensors for Diabetes Management: A Review of Technologies and Applications. Diabetes Metab J. 2019 Aug;43(4):383-397
6.- Blanchette JE, Switzer C, Poprik F. Diabetes Technology at Camp: A Rich Learning Environment. J Pediatr Nurs. 2019 May-Jun;46:126-127.
7.-Al-Beltagi M, Saeed NK, Bediwy AS, Elbeltagi R. Insulin pumps in children – a systematic review. World J Clin Pediatr. 2022 Nov 9;11(6):463-484.
8.- Benito Badorrey B. Diabetes mellitus en los dispositivos móviles. Diabetes Práctica 2015;06(02):49-96.
9.- Wunna W, Tsoutsouki J, Chowdhury A, Chowdhury TA. Advances in the management of diabetes: new devices for type 1 diabetes. Postgrad Med J. 2021 Jun;97(1148):384-390.
10.- Al-Beltagi M, Saeed NK, Bediwy AS, Elbeltagi R. Insulin pumps in children – a systematic review. World J Clin Pediatr 2022; 11(6): 463-484
